Madrid – El objetivo de la quimioterapia es destruir a las células tumorales con lesiones pero, a veces, la célula logra reparar la lesión y sobrevivir, burlando el efecto del fármaco. Ahora, un equipo de investigadores del Centro Nacional de Investigaciones Oncológicas de España (CNIO) ha descubierto cómo lo consigue, y plantean usar ese conocimiento para potenciar los tratamientos oncológicos.
El estudio, publicado en The EMBO Journal, y liderado por el investigador español del Centro Nacional de Investigaciones Oncológicas (CNIO) Juan Méndez, explica que la clave es la proteína PrimPol.
Una de las lesiones más comunes eficaces de la quimioterapia es impedir que se separen las dos hebras de la molécula de AND para que la maquinaria celular no pueda leer las instrucciones escritas por los genes y sea incapaz de funcionar o replicarse.
Por eso las lesiones que impiden la separación de las hebras del ADN son de las más graves que puede sufrir una célula; se denominan ICLs y pueden surgir de manera natural, por el propio metabolismo celular, u originarse con determinados tóxicos, como en la quimioterapia.
El cisplatino, usado en el tratamiento de los cánceres de ovario y pulmón, entre otros, elimina las células tumorales induciéndoles lesiones ICL.
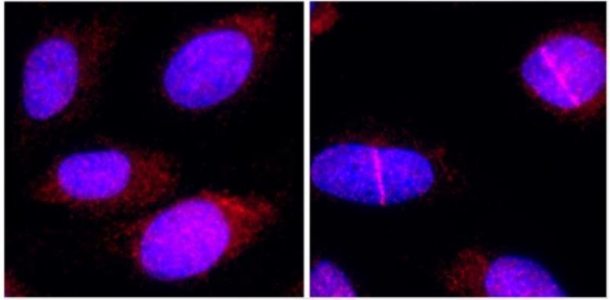
Pero a veces la célula sabe reparar esas lesiones, y tal y como desvela el estudio, lo consigue en parte gracias a PrimPol, una proteína de familia de las ‘primasas’ que apareció muy pronto en la evolución de la vida y hoy sigue presente en muchísimas especies.
En 2013, Juan Méndez y Luis Blanco, del Centro de Biología Molecular Severo Ochoa de España (CSIC), descubrieron que PrimPol es importante porque permite a la maquinaria celular utilizar las instrucciones escritas en el ADN incluso cuando este contiene algún error, es decir, hace a la célula más resistente y la ayuda a sobrevivir cuando su ADN esté dañado.
El nuevo trabajo ha estudiado la función de PrimPol cuando el fallo es una lesión ICL.
Los investigadores han visto que gracias a la participación de este enzima, la célula no solo sobrevive a las lesiones ICL, sino que además moviliza a la maquinaria encargada de repararlas, un hallazgo con «implicaciones muy interesantes» porque «al facilitar la reparación de ICLs, PrimPol está interfiriendo con la efectividad de la quimioterapia», observa Méndez.
Eso sugiere que si PrimPol no estuviera, la célula tumoral sería más sensible a la quimioterapia, de modo que, «si conseguimos reprimir la función de PrimPol en estas células, podríamos mejorar la eficiencia de la quimioterapia», concluye Méndez.
El estudio también tiene interés para la anemia de Fanconi, poco frecuente pero muy grave.
Los investigadores del CNIO demuestran que PrimPol facilita la reparación de las lesiones ICL por parte de una familia de proteínas llamadas FANC. Y son los fallos genéticos que reducen la actividad de esas proteínas los que causan la anemia de Fanconi.
«Los pacientes con anemia de Fanconi tienen muy pocas opciones terapéuticas, pero empieza a haber resultados muy prometedores con terapia génica», afirma.
«Todos los avances que permitan entender mejor las vías de reparación de ICLs pueden resultar útiles en un futuro próximo», concluye.